Thérapie génique
La thérapie génique repose sur l’utilisation d’un matériel génétique comme médicament. Au cours des deux dernières décennies, elle est devenue un réel espoir de traitement tant de maladies génétiques complexes et généralement rares comme les maladies neuromusculaires, que de maladies plus fréquentes comme les cancers.
Qu’est-ce que la thérapie génique ?
La thérapie génique consiste à introduire dans l’organisme du matériel génétique -de l’ADN ou de l’ARN- à des fins thérapeutiques.
Avec de premiers médicaments déjà commercialisés, elle représente un espoir pour de nombreuses maladies génétiques héréditaires mais aussi pour des cancers, des maladies du sang, des maladies neuro-dégénératives...
Comment ça marche ?

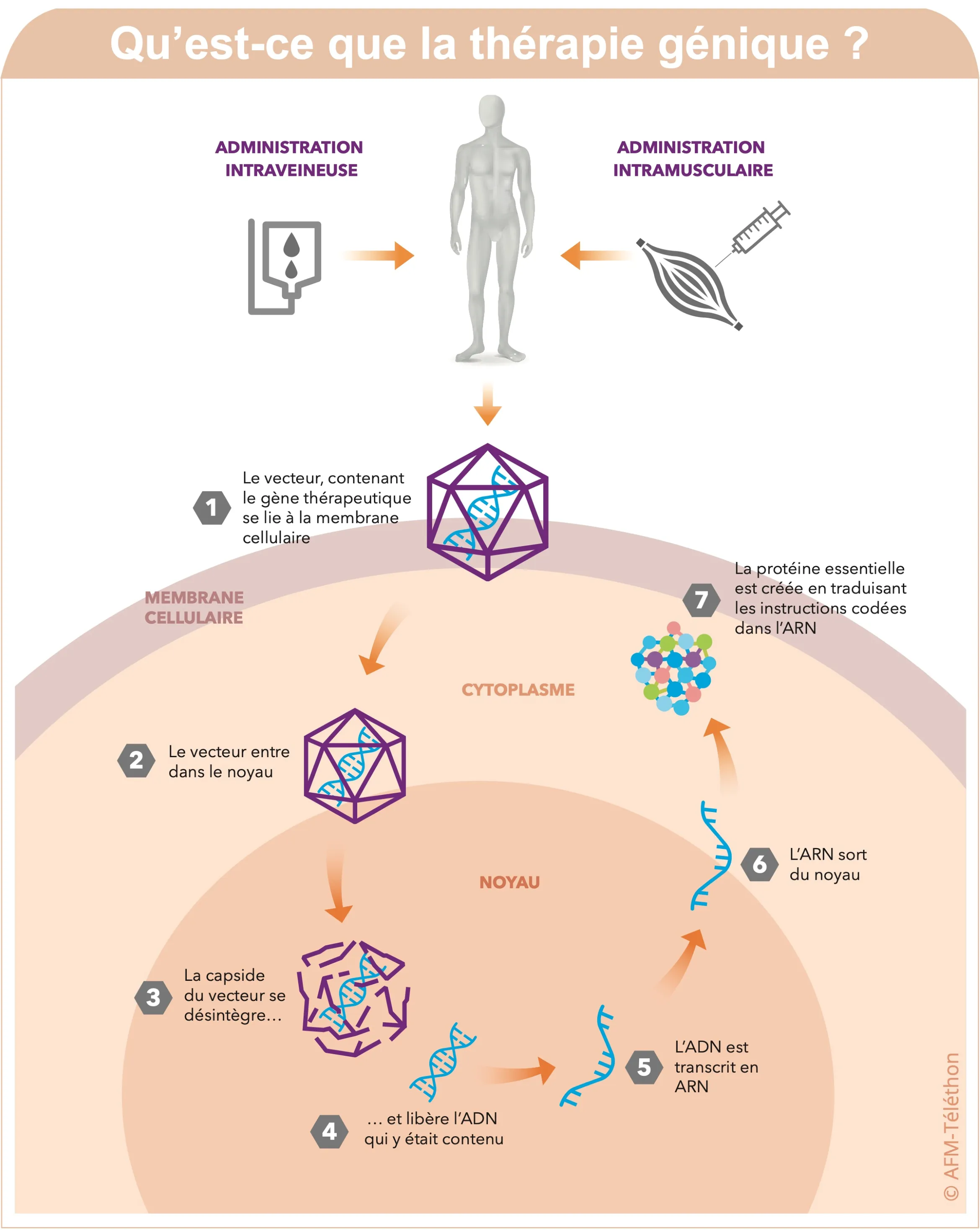
Le matériel génétique est inséré dans un vecteur: il s’agit d’un moyen de transport qui enveloppe et protège l'ADN ou l'ARN-médicament et lui permet d’être acheminé jusqu’aux noyaux des cellules cibles à « réparer ». C’est en général un virus, rendu inoffensif, mais d’autres types de vecteurs (synthétiques…) sont possibles.
Le saviez-vous ?
Dans les maladies neuromusculaires, le vecteur le plus utilisé comme moyen de transport d’un matériel génétique est le virus adéno-associé (AAV). Rendu inoffensif, il est facile à produire et permet d’exprimer le transgène sur le long terme.
Il existe une douzaine de souches d’AAV, qui ciblent différents organes (muscle, foie…). Par exemple, pour atteindre le muscle on utilisera plutôt des AAV8 et AAV9 ; pour le système nerveux central, c’est l’AAV9 le plus efficace…

Une fois dans le noyau, le vecteur se désintègre. Il libère le matériel génétique lequel est utilisé dans le noyau pour réparer la cellule malade :
- soit en fabriquant un ARN messager qui sera lui-même traduit en une protéine apportant à la cellule une fonction qu’elle n’a pas ou n’a plus,
- soit en éliminant/neutralisant un élément toxique,
- soit en corrigeant une anomalie génétique.
Selon le vecteur choisi, le matériel génétique peut s’intégrer ou non dans le génome des cellules traitées.
En général, les vecteurs sont "non intégratifs", c’est-à-dire que le matériel génétique qu'ils transportent reste dans le noyau sans s’intégrer à l’ADN de la cellule ciblée. C’est le cas du Zolgensma, traitement de l’amyotrophie spinale proximale (SMA). Le gène thérapeutique demeure dans le noyau des cellules nerveuses traitées toute leur vie sans s’insérer dans un chromosome.
Pour traiter des cellules qui se multiplient beaucoup (des cellules sanguines ou immunitaires par exemple), il est parfois nécessaire d’utiliser un vecteur "intégratif" : le matériel génétique s’insère dans le génome des cellules traitées, ce qui lui permet d’être conservé au fil des multiplications cellulaires. Il s’agit le plus souvent de vecteurs dérivés de lentivirus.
Lever les freins à la thérapie génique
Certaines personnes déjà exposées au virus utilisé pour fabriquer le produit de thérapie génique présentent des anticorps qui risquent de neutraliser le vecteur et l’empêcher d’agir. Généthon, le laboratoire spécialisé dans la thérapie génique créé par l’AFM-Téléthon, évalue l’efficacité et la tolérance d’un prétraitement à l’imlifidase (IDEFIRIX®) avant l’injection d’un produit de thérapie génique. Ce médicament, normalement prescrit avant une greffe rénale, pourrait détruire temporairement ces anticorps et engendrer les conditions optimales pour administrer la thérapie génique.
À lire : L’immunologie du transfert de gène : un enjeu essentiel
In vivo ou ex vivo : comment se transfère le produit de thérapie génique ?
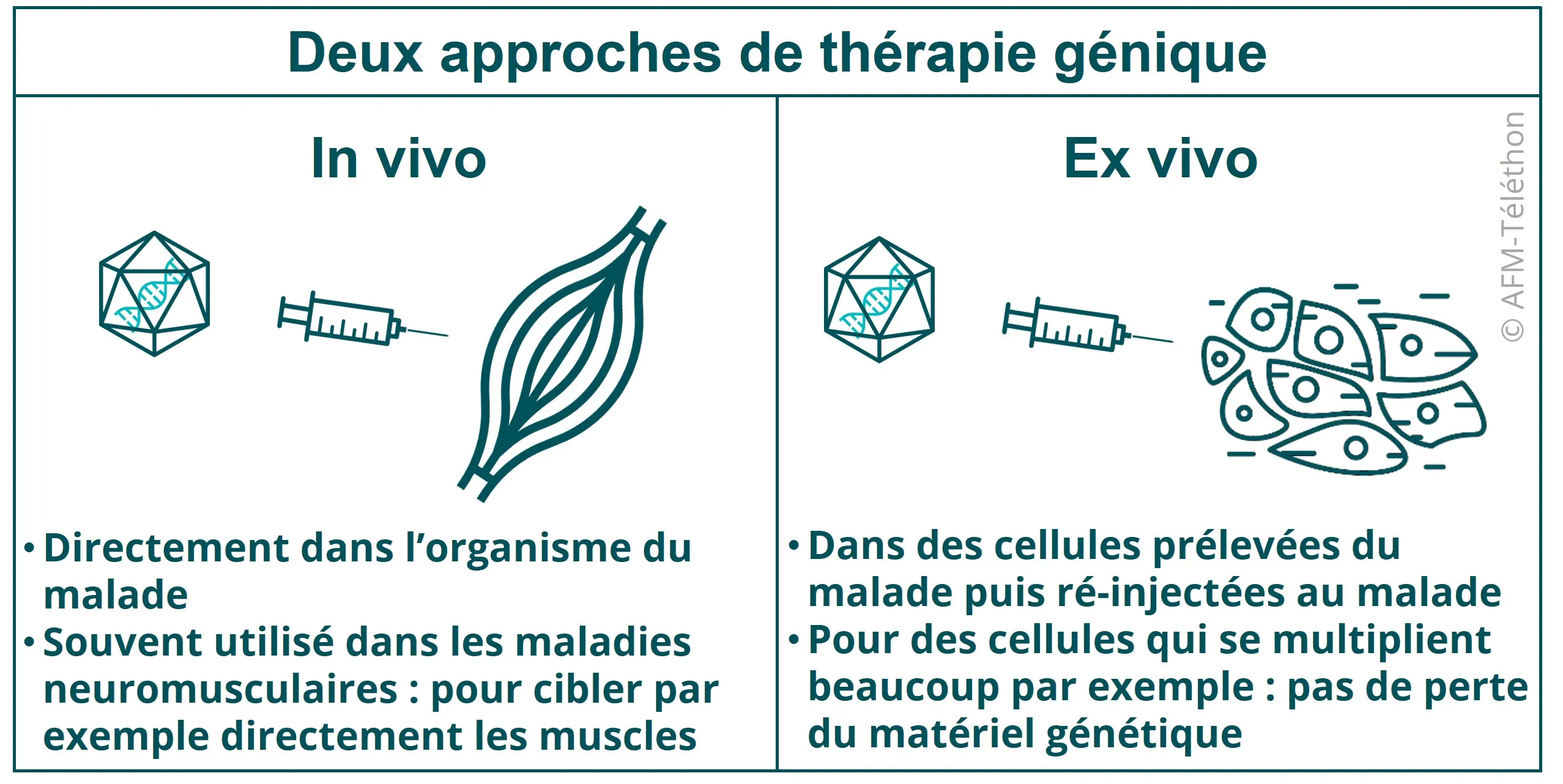
Le produit de thérapie génique peut être injecté directement dans la circulation sanguine pour atteindre l’ensemble du corps (comme dans la myopathie de Duchenne, où un essai évalue l’administration d’une microdystrophine par perfusion intraveineuse) ou au niveau d’une région plus localisée ou d’un organe (intramusculaire, intrathécale…) à traiter spécifiquement. Par exemple, dans une forme d’épidermolyse bulleuse, le produit de thérapie génique est appliqué directement au niveau d’une plaie ouvert sur la peau. On parle alors de thérapie génique in vivo.
Le produit de thérapie génique peut aussi être injecté à un petit nombre de cellules prélevées chez le malade puis cultivées et traitées en laboratoire. Elles sont ensuite réinjectées à la personne malade. C’est cette approche, dite de thérapie génique ex vivo, associant thérapie génique et thérapie cellulaire, qui a apporté un premier grand succès grâce au traitement des bébés-bulles atteints de déficit immunitaires sévères.
L’ARN peut-il être utilisé dans une thérapie génique ?
Oui car comme l’ADN, l’ARN porte l’information génétique.
D’après les autorités de santé françaises (ANSM) qui encadrent la commercialisation des produits de thérapie génique, ces produits sont considérés comme des médicaments constitués d’un acide nucléique, c’est-à-dire d’ADN ou d’ARN.
Où en est-on ?
Au début des années 1970 commençaient les recherches sur la thérapie génique. Les premiers résultats positifs remontent aux années 2000 : traitement des bébés-bulles en 2000, commercialisation d’un premier traitement en Chine contre une forme de cancer en 2003…
Depuis, d’autres traitements ont été commercialisés dans des déficits immunitaires, des maladies du sang, des maladies métaboliques, des maladies de la vue mais aussi dans l’amyotrophie spinale proximale (SMA), une maladie neuromusculaire. Les autorités sanitaires américaines recensaient, en novembre 2024, 41 médicaments de thérapie génique ou cellulaire autorisés.
Il s’agit d’une technologie encore en développement, complexe et très coûteuse. Les capacités de production des médicaments de thérapie génique sont encore limitées. Toutefois, de nombreuses maladies font l’objet d’essais cliniques de candidats-médicaments de thérapie génique.
Ainsi, en novembre 2024, la base de données ClinicalTrials recensait plus de 4 000 essais en cours ou en préparation dans le monde, principalement en Amérique du Nord et en Europe. La majorité des essais portent sur des formes de cancer et des maladies monogéniques (c’est-à-dire liées à une anomalie dans un seul gène).
La drépanocytose est une maladie génétique relativement fréquente (il y aurait environ 30 000 patients en France). Plusieurs approches de thérapie génique à l’essai ont montré des bénéfices sur le bien-être et la qualité de vie des patients traités.
Le cas des cancers
Si les premières études portaient sur le remplacement d’un gène défectueux dans des maladies monogéniques rares, le développement des approches de thérapie génique a rapidement permis d’envisager des thérapies innovantes pour des maladies plus fréquentes, et en premier lieu les cancers.
Deux approches sont possibles : soit stimuler le système immunitaire pour qu’il s’attaque aux cellules cancéreuses, soit fragiliser les cellules cancéreuses pour faciliter leur dégénérescence.
Depuis 2018, le traitement par des cellules CAR-T a été approuvé en Europe pour traiter deux cancers du sang chez les enfants et jeunes adultes. Ce traitement repose à la fois sur la thérapie génique et la thérapie cellulaire : on prélève des cellules du système immunitaire de la personne (des lymphocytes T ou globules blancs) qui s’attaquent normalement aux microbes et on les « arme » par transfert de gène avec des récepteurs artificiels CAR (pour chimeric antigen receptor), dirigés contre la tumeur. Réinjectées au patient, les cellules modifiées se multiplient, reconnaissent et détruisent les cellules cancéreuses.
Cette méthode de traitement commence à être explorée dans différentes maladies auto-immunes et notamment dans la myasthénie et les myosites.
Voir les médicaments commercialisés grâce à l’AFM-Téléthon
Découvrir les projets en cours de développement au Généthon
La révolution des biothérapies
La thérapie génique, pour quoi faire ? L’exemple des maladies neuromusculaires
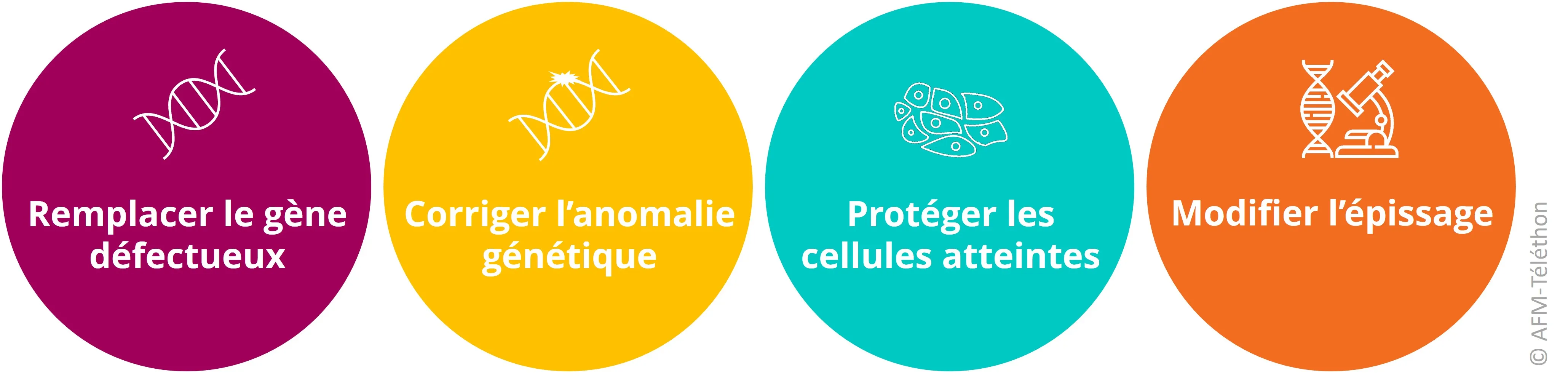
Remplacer le gène défectueux
C’est l’approche la plus avancée dans les maladies neuromusculaires, avec un médicament disponible pour les malades atteints de SMA, le Zolgensma®, et plusieurs essais cliniques en cours dans d’autres myopathies.
Par exemple :
Myopathie myotubulaire liée à l'X : essai ASPIRO
LGMD R9 liée à FKRP : essai GNT0006 (ATA-100)
Dystrophie musculaire de Duchenne : essai microdystrophine
Corriger une anomalie génétique
Le système CRISPR-Cas9 est un nouvel outil très performant de modification de l’information génétique (édition du génome). Il est constitué d’un ARN guide, qui reconnait spécifiquement une séquence sur l’ADN, et d’une nucléase Cas9 pour couper l’ADN à un endroit précis du génome.
Cette approche a montré de bons résultats chez des souris atteintes de DM1 et est aussi à l'étude dans la myopathie de Duchenne.
Apporter un gène thérapeutique pour protéger les cellules atteintes
Cette approche est encore au stade expérimental, avec des résultats encourageants en laboratoire.
Par exemple :
- Une protéine-leurre qui cible spécifiquement les agrégats toxiques dans la DM1 réduit les signes de la maladie chez des souris malades.
- Le transfert du gène de la neurotrophine 3 codant une protéine qui protège et stimule les cellules de Schwann serait capable de limiter l’atteinte des nerfs périphériques dans la CMT 1A et X1.
Apporter un ARN médicament pour…
• diminuer la fabrication d’une protéine
Pour cela, les chercheurs utilisent des oligonucléotides antisens, des petits ARN interférents, des micro-ARN ou des petits ARN en épingle à cheveux qui se différencient par leur taille et leur composition chimique.
Plusieurs candidats-médicaments sont à l’essai dans la maladie de Steinert.
Cette approche est aussi en développement pré-clinique dans la maladie de Charcot-Marie-Tooth 1A avec des premiers résultats encourageants.
• modifier l’épissage
Certaines approches agissant sur l’épissage (la maturation) d’un gène sont à l’étude : avec le saut d’exon dans la myopathie de Duchenne, comme par exemple avec l’eteplirsen, ou la réintégration d’exon dans l’amyotrophie spinale proximale liée à SMN1, comme par exemple avec le Spinraza®.
Les effets positifs à long terme de l’eteplirsen se confirment dans la myopathie de Duchenne
