Le Zolgensma® dans la SMA
Le Zolgensma® est le premier traitement de thérapie génique autorisé dans l’amyotrophie spinale proximale liée à SMN1. En Europe, il est disponible depuis mai 2020 sous certaines conditions. Avec le Spinraza® et l’Evrysdi® il vient compléter l’arsenal thérapeutique innovant dans cette maladie.

Le Zolgensma®, qu’est-ce que c’est ?
Le Zolgensma® (ou onasemnogene abeparvovec) est un produit de thérapie génique, une approche thérapeutique innovante qui consiste à remplacer un gène défectueux en apportant un gène fonctionnel à l’aide d’un moyen de transport appelé « vecteur ».
Pour le Zolgensma®, c’est un gène SMN1 fonctionnel qui est apporté afin de remplacer le gène SMN1 défectueux dans l’amyotrophie spinale proximale liée à SMN1 (SMA). Le but est d’ainsi fabriquer la protéine SMN (pour Survival motor neuron), manquante dans la maladie.
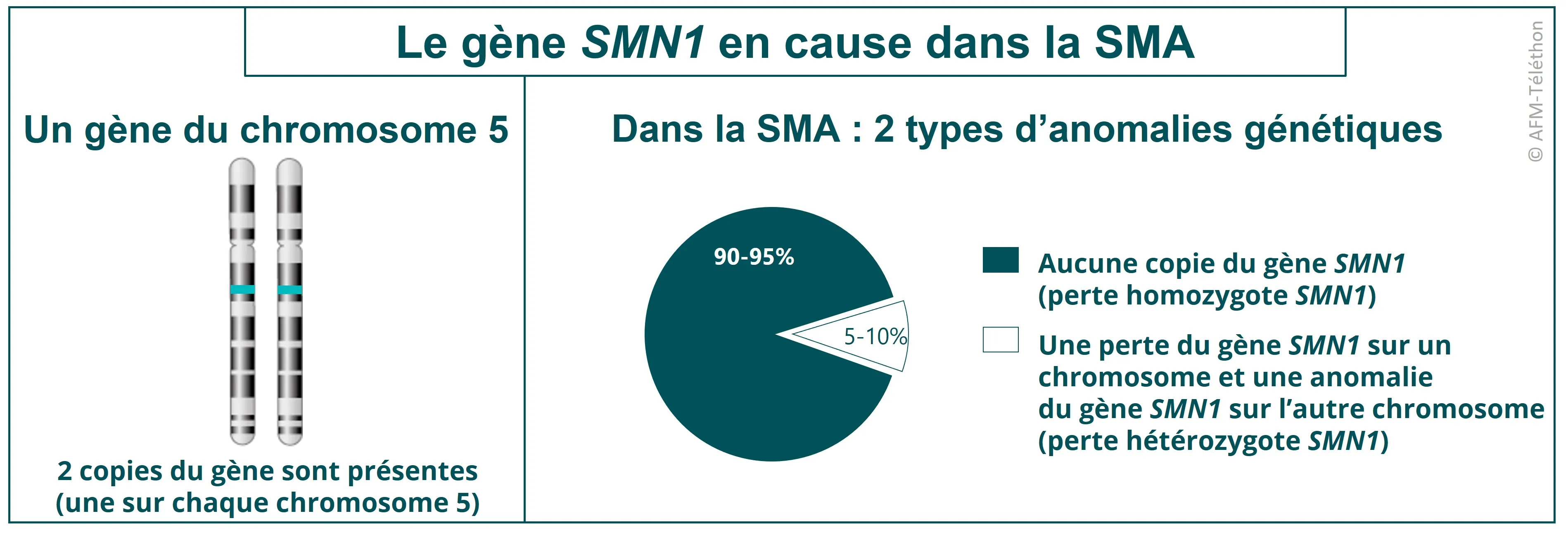
Le vecteur utilisé est un AAV9 (pour virus adéno-associé de type 9) qui est capable de franchir la barrière entre la circulation sanguine et le système nerveux central (la barrière hémato-encéphalique) pour atteindre le système nerveux central et ainsi les motoneurones, lesquels sont endommagés dans la SMA.
L’AAV, un bon outil de thérapie génique
Le moyen de transport ou vecteur le plus utilisé pour la thérapie génique dans les maladies neuromusculaires est le virus adéno-associé (AAV). Celui-ci est rendu inoffensif et permet une expression à long terme du matériel génétique transporté.
Il existe plusieurs souches d’AAV qui vont cibler différents organes (le muscle, l’œil, le foie…). Par exemple, pour cibler le muscle, ce sont les AAV8 et AAV9 qui sont les plus efficaces ; pour le système nerveux central, c’est l’AAV9…
Des travaux de recherche pionniers menés dans les laboratoires de l’AFM-Téléthon
C’est une équipe de l’Institut de Myologie et de Généthon, deux institutions crées par l’AFM-Téléthon, qui a montré pour la première fois, en 2009, l’efficacité de la thérapie génique dans des modèles animaux de SMA.
Une licence d’utilisation des brevets liés au produit AAV9-SMN ainsi qu’à son administration a été octroyée en 2018 par Généthon à AveXis, le laboratoire qui a initialement développé le Zolgensma® avant d’être racheté par Novartis.
À qui s’adresse le Zolgensma® ?
Disponible d’abord aux États-Unis depuis mai 2019, le Zolgensma® a ensuite obtenu en Europe, en mai 2020, une autorisation de mise sur le marché (AMM) dite « conditionnelle ». Cela signifie qu’il est disponible sous certaines conditions :
Les indications en Europe
Le Zolgensma® ne concerne que les bébés et les jeunes enfants pesant moins de 21 kg présentant une SMA de type I ou porteur d’une mutation bi-allélique du gène SMN1 et de 3 copies du gène SMN2 maximum.
En France, le Zolgensma® est disponible dans le cadre d’un dispositif post-ATU qui suit les mêmes conditions que l’AMM européenne.
En décembre 2020, la Haute Autorité de Santé (HAS) a rendu un avis favorable au remboursement du produit pour la SMA de type I et II ou présymptomatique avec jusqu’à 3 copies du gène SMN2. D’autres étapes réglementaires sont encore nécessaires jusqu’à la commercialisation du médicament en France.
Des jeunes enfants éligibles avec peu d’anticorps contre l’AAV9
Dans notre quotidien, nous sommes naturellement exposés aux AAV. Certains d’entre nous vont alors produire des anticorps dits « neutralisants » pour se protéger de ces AAV. Ces personnes pourront difficilement recevoir un produit de thérapie génique avec un AAV car leurs anticorps neutralisants risqueraient de bloquer le produit et de l’empêcher d’être efficace.
Une grande étude datée de février 2021 a montré chez 196 jeunes enfants atteints de SMA, âgés de moins de 5 ans et ayant participé à un essai clinique avec le Zolgensma® ou l’ayant reçu dans le cadre d’un accès anticipé, qu’ils présentaient de faibles taux d’anticorps neutralisants contre l’AAV9. La majorité des jeunes malades atteints de SMA est donc éligible à recevoir du Zolgensma® sur le plan immunitaire.
Quelle est l’efficacité du Zolgensma® ?
Aujourd’hui commercialisé par Novartis, le Zolgensma® a montré des bénéfices rapides et qui persistent dans le temps : amélioration des performances motrices des patients et respiration de façon autonome, allongement de l’espérance de vie… Des bénéfices incontestables face à la gravité de cette maladie.
Les données d’efficacité du Zolgensma® ont été obtenues au travers de plusieurs essais cliniques qui ont principalement concerné des jeunes malades atteints de SMA de type I ou de SMA présymptomatiques.
Elles varient cependant selon les malades, en fonction du type de SMA, de l’âge de début du traitement, des symptômes présents au moment de la mise en route du traitement…
D’autres essais cliniques sont en cours ou en préparation pour continuer d’affiner les données d'efficacité et de sécurité du Zolgensma® ou pour évaluer ses effets sur d’autres paramètres (malades pesant plus de 21 kg, réinjection du produit…).
Pour en savoir plus sur les essais cliniques dans la SMA en France
Traiter le plus tôt possible, et donc dépister
Les résultats de l’essai SPR1NT, réalisé chez des nourrissons ayant reçu le Zolgensma® dès leurs 6 premières semaines de vie, c'est-à-dire avant l’apparition des symptômes de la maladie (en présymptomatique), confirment qu’un traitement à ce stade est plus efficace qu’après (en phase symptomatique).
Pour traiter le plus tôt possible, il faut pouvoir diagnostiquer la maladie le plus tôt possible. Ceci est faisable grâce au dépistage à la naissance (néonatal) de la maladie.
En France, sous l'impulsion de l'AFM-Téléthon, un programme préfigurateur de dépistage de la SMA , le Projet DEPISMA, a démontré la faisabilité du dépistage néonatal de la SMA dans deux régions de France, la région Grand Est et Nouvelle-Aquitaine, sur une durée de deux ans, chez tous les nourrissons âgés de 1 à 5 jours. Suite à ces résultats positifs et concluants, le déploiement du dépistage néonatal au niveau national est prévu à partir du 1er septembre 2025.
Pour en savoir plus sur le programme DEPISMA
Si le Zolgensma® améliore considérablement la vie des malades, il ne permet cependant pas de guérir complètement la maladie. D’où l’importance de poursuivre une prise en charge médicale qui va traiter les symptômes de la maladie, avec par exemple la kinésithérapie orthopédique et respiratoire…
Quels peuvent être les effets indésirables ?
Les principaux effets indésirables sous Zolgensma® sont une augmentation du taux d’enzymes du foie et des vomissements.
Des effets secondaires graves sont bien plus rares mais peuvent être préoccupants : insuffisance hépatique, microangiopathie thrombotique, problème cardiaque…
Maintenant qu’ils ont été identifiés, ils peuvent être anticipés et traités de manière préventive, par exemple avec un traitement transitoire par corticoïdes.
Compte tenu de la gravité de la maladie, le rapport bénéfice/risque du Zolgensma® reste favorable, l’initiation du traitement étant quoi qu’il arrive décidée au cas par cas.

Peut-on avoir un autre traitement de la SMA en complément ?
Les trois traitements disponibles dans la SMA, le Zolgensma®, le Spinraza® et l’Évrysdi®, ont pour objectifs communs d’augmenter la fabrication de protéine SMN via des mécanismes différents.
À ce jour, aucune étude n’a encore comparé l’efficacité de ces trois traitements, le choix du traitement doit se discuter avec le médecin.
De premières publications commencent à décrire les effets d’associations de ces médicaments mais elles ne concernent que des très petits nombres de malades à ce jour, insuffisants pour conclure de façon formelle à leur efficacité.
Plusieurs essais cliniques sont toutefois en cours ou en préparation pour répondre à cette question sur de plus grands nombres de participants, à l’image des essais RESPOND (associant Zolgensma® et Spinraza®) ou MANATEE (associant Spinraza® et Évrysdi®) ou JEWELFISH (associant Zolgensma® et Évrysdi®).

Comment prend-on le Zolgensma® ?
Le produit de thérapie génique Zolgensma® est administré lors d’une perfusion intraveineuse (goutte-à-goutte) unique d’une durée d’une heure environ, à l’hôpital.
Sa prescription hospitalière s’effectue après avis d'une Réunion de Concertation Pluridisciplinaire au sein de la filière de soins FILNEMUS.
Des examens médicaux (comme des tests hépatiques et sanguins) accompagnent cette perfusion.
Un traitement par corticoïdes par voie orale est également nécessaire pour réduire certains effets indésirables du traitement, un jour avant l’injection de Zolgensma® et pendant près de deux mois.