L’Évrysdi® dans la SMA
Troisième médicament autorisé dans l’amyotrophie spinale proximale liée à SMN1 après le Spinraza® et le Zolgensma®, l’Évrysdi® (risdiplam) est le seul qui se prend par voie orale, à domicile. En France, il est disponible pour les personnes atteintes de SMA de type I, II et III et bientôt dans la SMA présymptomatique.

L’Évrysdi®, c’est quoi ?
L’Évrysdi® (risdiplam) est un médicament très récent de l’amyotrophie spinale proximale liée à SMN1 (SMA) développé par les laboratoires Hoffmann-La Roche et PTC Therapeutics en collaboration avec la SMA Foundation.
Un médicament pour produire la protéine SMN
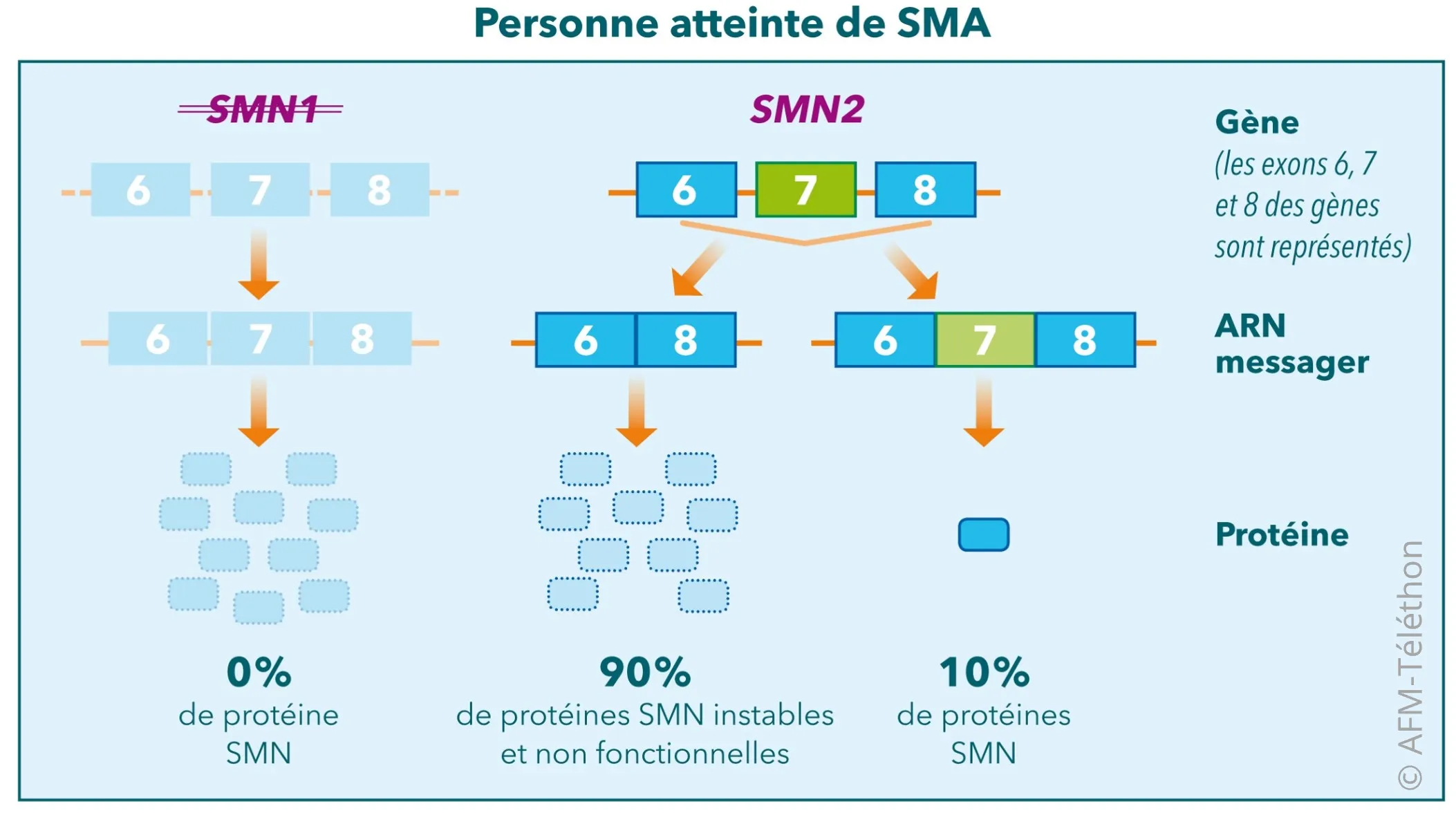
L’Évrysdi® augmente la production de protéine SMN (pour Survival motor neuron), molécule indispensable à la survie des motoneurones et manquante dans l’amyotrophie spinale proximale liée à SMN1.
Comme le gène SMN1 est défectueux dans cette maladie, l’Évrysdi®agit sur le gène SMN2, dont la séquence est quasi identique à la différence d’un nucléotide (une « lettre » du message génétique) situé dans une portion de gène appelée exon 7. Le gène SMN2 peut également fabriquer la protéine SMN, en lui faisant réintégrer l’exon 7.
Un médicament en solution buvable
Contrairement au Spinraza® qui nécessite une injection intrathécale et au Zolgensma® qui requiert une injection intraveineuse, l’Évrysdi® est un médicament en poudre à remettre en suspension qui se prend par voie orale ou par une sonde d’alimentation, une fois par jour à domicile.
La solution buvable doit être reconstituée par un professionnel de santé, par exemple le pharmacien qui délivre le traitement. La dose quotidienne dépend de l'âge et du poids du malade. Elle se prend à l’aide d’une seringue orale réutilisable fournie, après un repas, toujours à la même heure, et immédiatement après avoir été prélevé dans la seringue orale (s’il se passe plus de 5 minutes, le produit doit être jeté et une nouvelle dose doit être préparée). Pour bien l’avaler, le malade doit boire de l’eau (ne pas mélanger avec du lait).
La solution buvable se conserve au réfrigérateur (pendant 64 jours maximum). Elle peut être conservée exceptionnellement à température ambiante pendant 5 jours maximum. Ensuite elle doit ensuite être replacée au réfrigérateur ou jetée.
Début juin 2025, la Commission européenne a autorisé une alternative cette solution buvable, avec une formulation en comprimé, stable à température ambiante, afin d’offrir plus d’indépendance aux malades.
Qui peut prendre de l’Évrysdi® ?
En Europe, l’Évrysdi® a obtenu en mars 2021 une autorisation de mise sur le marché pour « les malades âgés de plus de deux mois, avec un diagnostic clinique de SMA de type I, de type II ou de type III ou avec une à quatre copies du gène SMN2 ».
En août 2023, la Commission Européenne a rendu un avis positif pour que l’Evrysdi® puisse être administré dès la naissance et non à partir de l’âge de deux mois. Il faudra toutefois encore compter quelques temps avant que cette nouvelle indication puisse être effective en France.
Un médicament disponible en pharmacie
En France, l’Évrysdi® est commercialisé et remboursé pour les malades atteints de SMA de type I, II et III et bientôt dans la SMA présymptomatique.
Sa prescription reste réservée aux neurologues ou neuropédiatres des Centres de référence ou de compétences des maladies rares neuromusculaires de la filière Filnemus. Il est donc prescrit à l’hôpital, mais disponible en pharmacie.
En première intention
Pour la Haute Autorité de Santé, l’Évrysdi® peut être utilisé en première intention :
- chez les personnes atteintes de SMA de type I symptomatique, au même titre que Spinraza® et Zolgensma®,
- chez les personnes atteintes de SMA de type II et III, au même titre que Spinraza®.
Quelle est son efficacité ?
L’Évrysdi® a montré qu’il améliore ou stabilise la fonction motrice dans la SMA de type I (essai FIREFISH) et de type II et III (Essai SUNFISH). Pour la SMA de type I, l’espérance de vie des malades est également allongée. Le besoin d’un ventilateur pour aider à respirer est diminué. Ces effets sont toutefois variables d’une personne à l’autre.
Ils tendent cependant à montrer que plus le traitement est pris tôt, plus le traitement sera efficace.
L’efficacité de l’Évrysdi® continue d’être évaluée au travers de plusieurs essais cliniques menés auprès de différents groupes de malades : SMA de type I, II, III, présymptomatiques… Ils vont permettre d’affiner les données d'efficacité et de sécurité obtenues.
Pour en savoir plus sur les essais cliniques dans la SMA en France
| Essai | Cible | Nombre de participants | Âge | Pays |
|---|---|---|---|---|
| Essai FIREFISH en ouvert | SMA type I | 62 | 1 à 7 mois | France et étranger |
| Essai SUNFISH en double aveugle, contre placebo | SMA type II et III | 231 | 2 à 25 ans | France et étranger |
| Essai JEWELFISH en ouvert | SMA déjà traitée par Spinraza®, Zolgensma® ou olésoxime | 174 | 6 mois à 60 ans | France et étranger |
| Essai RAINBOWFISH en ouvert | SMA présymptomatique | 26 | Moins de 6 semaines | Étranger |
| Essai PUPFISH en ouvert | SMA présymptomatique | 10 | Moins de 20 jours | Étranger |
Si ce traitement entraine de nombreux bénéfices cliniques, il ne permet pas la guérison complète de la maladie, c’est pourquoi une prise en charge symptomatique, telle que la kinésithérapie orthopédique et respiratoire, est importante.
Quels sont les effets indésirables les plus fréquents ?
Parmi les effets indésirables que peut provoquer l’Évrysdi®, les plus fréquents sont une diarrhée, une éruption cutanée, des maux de tête et de la fièvre.
Un peu moins fréquemment, les malades peuvent avoir des nausées, des aphtes, une infection urinaire et des douleurs articulaires.
Ce traitement étant toujours en cours d’évaluation, d’autres effets secondaires encore non rapportés peuvent également y être associés. Ils doivent être signalés auprès du professionnel de santé qui suit le malade et/ou auprès des agences réglementaires de santé françaises.
À noter que pour les femmes en âge de procréer, une contraception hautement efficace doit être utilisée pendant toute la durée du traitement et au moins un mois après la dernière dose. Elles doivent arrêter le traitement en cas de désir de grossesse. Le traitement peut également avoir des risques sur la fertilité masculine.
Quels autres traitements spécifiques de la SMA existent-ils ?
En plus de l’Évrysdi®, il existe deux autres médicaments spécifiques de la SMA :
- un oligonucléotide antisens Spinraza® (nusinersen) qui agit, comme l’Évrysdi®, sur le gène SMN2 pour augmenter la production de protéine SMN.
- un produit de thérapie génique Zolgensma® (onasemnogene abeparvovec) qui vient apporter un gène SMN1 fonctionnel dans le but de fabriquer la protéine SMN.
À ce jour, aucune étude n’a encore comparé l’efficacité de ces trois traitements, le choix du traitement doit se discuter avec le médecin. Par ailleurs, peu de publications, et sur des petits nombres de malades, rapportent les effets d’une association de ces traitements. Pour mieux en connaitre l’efficacité, des essais cliniques, sur un plus large nombre de participants, sont en cours, comme l’essai RESPOND (Zolgensma® et Spinraza®) ou l’essai MANATEE (Spinraza® et Évrysdi®).
