SMA : le Zolgensma obtient une AMM conditionnelle en Europe et une ATU de cohorte en France

Après les États-Unis et le Japon, c’est au tour de l’Europe d’autoriser, sous certaines conditions, le produit de thérapie génique Zolgensma dans la SMA.
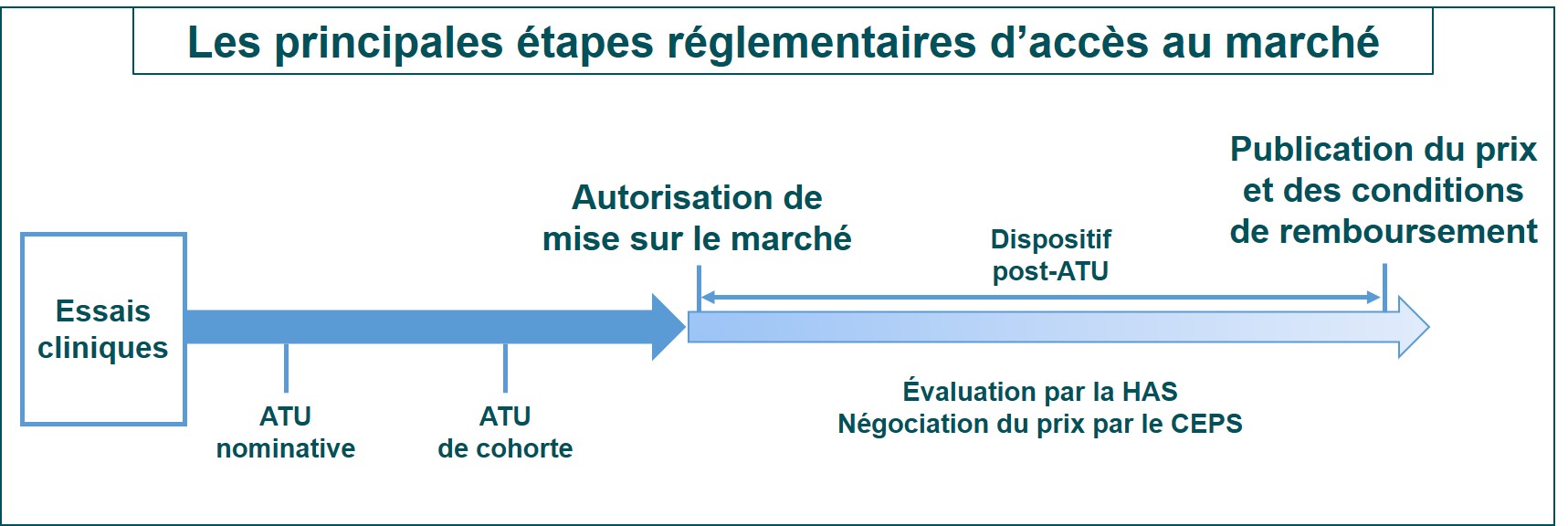
En Europe, une autorisation de mise sur le marché conditionnelle
La Commission européenne a octroyé une autorisation de mise sur le marché (AMM) « conditionnelle » du Zolgensma (onasemnogene abeparvovec), produit de thérapie génique qui s’administre en une seule injection intraveineuse, dans l’amyotrophie spinale proximale liée à SMN1 (SMA). Cette autorisation, qui fait suite à l’avis favorable donné par le CHMP en mars dernier, s’appuie sur des résultats d’essais cliniques positifs, notamment sur le développement moteur dans la SMA de type I, II ou présymptomatique.
Cette AMM ne concerne que les bébés et les jeunes enfants pesant moins de 21 kg présentant une SMA de type 1 ou porteur d’une mutation bi-allélique du gène SMN1 et de 3 copies du gène SMN2 maximum.
Les autorités de santé de chaque pays d’Europe vont désormais évaluer la valeur thérapeutique et économique du traitement afin d’en finaliser la commercialisation sur leur territoire.
En France, une ATU de cohorte
En France, le Zolgensma est prescrit depuis le 25 mai 2020 dans le cadre d’une autorisation temporaire d’utilisation (ATU) de cohorte. Selon ce qui est indiqué dans le Protocole d’utilisation thérapeutique (PUT) et de recueil d’informations qui l’accompagne, cette ATU de cohorte concerne les patients pesant moins de 21 kg « avec diagnostic clinique d’amyotrophie spinale proximale liée à SMN1 (SMA) de type 1 ou atteints de SMA avec une mutation bi-allélique du gène SMN1 et jusqu’à trois copies du gène SMN2 ». Le Zolgensma est réservé à l’usage hospitalier et sera prescrit après avis d’une Réunion de Concertation Pluridisciplinaire au sein de la filière de soins FIlnemus.
Ce dispositif va permettre à un plus grand nombre de patients d’être traités par le Zolgensma en attendant que ce dernier soit commercialisé en France. Les étapes suivantes vers la commercialisation en France sont les avis sur les données cliniques (service médical rendu) et médico-économiques (amélioration du service médical rendu) de la Commission de la transparence et la Commission d’évaluation économique et de santé publique de la Haute Autorité de Santé. Puis, le Comité Economique des Produits de Santé (CEPS) va négocier le prix du traitement. Le ministère des Solidarités et de la Santé prendra la décision finale quant au remboursement du traitement qui sera publiée au Journal Officiel.
Source
Voir le site de l’Agence Européenne des médicaments (EMA) : EPAR mis à jour le 27 mai 2020
Voir la liste des ATU de cohorte en cours sur le site de l’ANSM
Voir le Protocole d’utilisation thérapeutique (PUT) et de recueil d’informations du Zolgensma (PDF)
